Механизмы задержки внутриутробного развития ребенка при хронической плацентарной недостаточности
Год публикации: 2009
Автор: Джамшед Додхоев

ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Одним из стратегических направлений социальной политики государства является реализация национальной программы медико-социальных мер, направленных на улучшение здоровья женщин и детей (Вельтищев Ю.Е,, 2000; Шарапова О.В., 2003; Таболин В.А. И др., 2003; Баранов А.А,, 2005; Володин Н.Н,, 2007).
В последнее десятилетие у детей наблюдается рост соматических и нервно-психических заболеваний, истоки которых в 70% случаев кроются в патологии антенатального развития и раннего неонатального периода жизни (Евсюкова И.И,, 1997; Рыжавский Б.Я., 1999; Барашнев Ю.И,, 2000; Пальчик А.Б., 2000). Наиболее высока частота неблагоприятных последствий у детей, имеющих задержку внутриутробного развития (Дементьева Г.М., 1984; Вельтищев Ю.Е., 2000). Известно, что у них значительно затруднен процесс постнатальной адаптации, нарушено становление функций нервной, сердечно-сосудистой и других функциональных систем организма (Евсюкова И.И,, 2004). В связи с этим актуальной проблемой является изучение патогенеза задержки внутриутробного развития (ЗВУР) ребенка с целью разработки адекватных подходов к профилактике, ранней коррекции выявленных нарушений и оптимальной реабилитации.
Известно, что одним из наиболее значимых факторов, ведущих к формированию синдрома задержки внутриутробного развития плода является осложнение беременности гестозом и развитие хронической плацентарной недостаточности (Бунин А.Т., 1993; Макаренко М.О., 2000; Popovici R.M. et al., 2001). Возникающие при этом иммунные, трофические, эндокринные и метаболические нарушения функций плаценты наряду с активацией свободнорадикального окисления оказывают на плод повреждающее воздействие, характер и степень которого во многом зависят от его продолжительности и срока гестации (Прокопенко В.М., 2000; Пагава К.И. И др., 2003).
Результаты изучения плаценты как органа, играющего исключительно важную роль в регуляции взаимоотношений между матерью и плодом во время беременности, свидетельствует о важной роли пептидных гормонов и биогенных аминов (Айламазян Э.К., Кветной И.М., 2003; Пальцев М.А., Кветной И.М., 2008). Последние в значительной мере определяют морфофункциональное развитие органов плода и становление синаптических связей, эффективность адаптивных реакций после рождения в новых условиях окружающей среды (Sorokin S.P. Et al., 1997; Евсюкова И.И,, 2006). Однако имеющиеся в литературе сведения, касающиеся продукции при хронической плацентарной недостаточности пептидных гормонов и биогенных аминов, в частности, мощного антиоксиданта мелатонина, немногочисленны, а онтогенетические аспекты подобного влияния практически не изучены.
Многочисленные исследования посвящены изучению влияния на плод возникающей при хронической плацентарной недостаточности гипоксии (Аскарова Н.К. и др., 1997; Чернышев В.Н. и др., 1998; Шабалов Н.П. и др., 1999; Пальчик А.Б., 2000). Установлено, что при хронической гипоксии нарушено формирование циклической организации сна, что определяет особенности становления механизмов регуляции сердечной деятельности, дыхания и других функций организма ребенка в период ранней постнатальной адаптации и в значительной степени влияет на последующее развитие ребенка (Евсюкова И.И., 1985, 2004; Шевченко О.Т., 1986; Косов М.Н., 1999).
Поскольку в основе этих нарушений лежат возникающие в условиях гипоксии изменения метаболических процессов в тканях, изучене состояния системы свободнорадикального окисления (СРО) и антиоксидантной защиты (АОЗ), а также продукции антиоксиданта мелатонина представляется чрезвычайно важным для определения новых подходов к профилактике и патогенетической терапии.
Цель настоящей работы — выяснить роль возникающих в условиях хронической плацентарной недостаточности изменений состояния системы свободнорадикального окисления/антиоксидантной защиты и продукции мелатонина в генезе задержки внутриутробного развития ребенка, определить принципы патогенетической терапии для профилактики неблагоприятных последствий.
Задачи исследования:
- Изучить состояние здоровья, течение беременности и родов, а также гистологические особенности последов у матерей, беременность у которых осложнилась развитием хронической плацентарной недостаточности и синдрома задержки внутриутробного развития плода.
- Изучить экспрессию мелатонина в плаценте в норме, а также при хронической плацентарной недостаточности и ЗВУР плода.
- Изучить клиническое состояние и циклическую организацию сна у доношенных новорожденных детей, имеющих симметричную и асимметричную формы ЗВУР различной степени тяжести.
- Изучить состояние свободнорадикального окисления (СРО), антирадикальной активности (АРА) и общей антиокислительной активности (ОАА) у новорожденных детей, внутриутробное развитие которых протекало в нормальных условиях и при хронической плацентарной недостаточности.
- Изучить экскрецию
6-сульфатоксимелатонина (6-СОМТ) с мочой у новорожденных детей здоровых и имеющих ЗВУР различной степени тяжести. - Изучить активность мозгового и сердечного изоферментов креатинкиназы у здоровых новорожденных и имеющих ЗВУР различной степени тяжести.
- Сопоставить результаты функциональных и биохимических исследований с клиническим состоянием новорожденных детей и их неврологическим статусом и определить роль возникающих при развитии в условиях хронической плацентарной недостаточности расстройств в генезе задержки формирования функций ЦНС.
Научная новизна:
- Впервые на основании анамнеза и результатов комплексного клинического обследования матери и новорожденного в сопоставлении с данными гистологического исследования последа и экспрессии в нем мелатонина определена группа высокого риска нарушений развития функций ЦНС среди новорожденных детей с ЗВУР.
- Впервые установлено, что дисбаланс системы СРО/АОЗ имеет место у новорожденных с тяжелой формой ЗВУР и отставанием функционального развития ЦНС.
- Показано, что степень снижения антирадикальной активности у новорожденных детей с ЗВУР коррелирует с содержанием в организме мелатонина.
- Наличие ЗВУР в сочетании с нарушением циклической организации сна и отставанием формирования позотонических и рефлекторных реакций наблюдается у доношенных детей, имеющих низкую продукцию мелатонина.
- Установлено, что повышение активности мозгового и сердечного изоферментов креатинкиназы (СК-ВВ, СК-МВ) при наличии ЗВУР и отставания формирования функций ЦНС указывает на повреждение клеточных мембран в условиях хронической гипоксии. Чем выше активность сердечного изофермента креатинкиназы, тем ниже сократительная способность миокарда, что сопровождается появлением гемодинамических расстройств и замедлением постнатальной адаптации.
- Результаты биохимических исследований в сопоставлении с данными электрофизиологических исследований и клинического состояния свидетельствуют о том, что развитие в условиях субкомпенсированной хронической плацентарной недостаточности приводит к нарушению целостности клеточных мембран органов и систем, что требует применения в раннем неонатальном периоде специфической терапии.
Теоретическая значимость:
Результаты исследований показали, что в генезе тяжелых поражений центральной нервной системы, сердечно-сосудистой системы и других функциональных систем у новорожденных в ЗВУР существенную роль играет дисбаланс системы СРО/АОЗ и снижение продукции мелатонина, возникающие в результате хронической внутриутробной гипоксии.
Полученные данные открывают новое направление исследований для выяснения роли биогенных аминов в формировании нарушений психомоторного развития в последующие месяцы и годы жизни у детей, родившихся с ЗВУР.
Практическая значимость:
Установлены критерии прогнозирования у новорожденных детей задержки внутриутробного развития (ЗВУР) с отставанием формирования функций ЦНС.
Показана необходимость проведения электрополиграфических исследований циклической организации сна и определены критерии оценки тяжести поражения ЦНС, способности к восстановлению и развитию нарушенных функций.
Определение активности нейроспецифического и сердечного изоферментов креатинкиназы дает возможность судить о тяжести поражения ЦНС и сердечно-сосудистой системы у новорожденных детей с ЗВУР на клеточном уровне.
Показана необходимость определения уровня экскреции
Исследование перекисного окисления липидов, антирадикальной активности и общей антиокислительной активности крови у новорожденных с тяжелой степенью ЗВУР позволяет определить необходимость и способ коррекции нарушений в системе СРО/АОЗ.
Основные положения, выносимые на защиту:
- Среди доношенных новорожденных с ЗВУР отобраны дети, у которых наряду с отставанием массо-ростовых показателей от должных величин имеется задержка формирования позотонических, рефлекторных реакций и нарушено становление циклической организации сна. Эти изменения имеют место у детей при наличии патологической незрелости плаценты и субкомпенсированной хронической плацентарной недостаточности с избыточной экспрессией мелатонина.
- При наличии ЗВУР в сочетании с отставанием формирования функций ЦНС у ребенка наблюдается дисбаланс системы СРО/АОЗ и низкая продукция мелатонина на протяжении всего раннего неонатального периода жизни, что играет существенную роль в генезе задержки функционального развития ЦНС и неврологических расстройств.
- Показатели активности мозгового и сердечного ферментов креатинкиназы являются объективными критериями степени тяжести нарушений функций ЦНС и сократительной способности миокарда у детей с ЗВУР.
- Наличие нарушений функционального развития ЦНС и дисбаланс системы СРО/АОЗ в сочетании с низкой продукцией мелатонина у новорожденных детей с ЗВУР являются объективными критериями тяжести перенесенной гипоксии и определяют необходимость включения в терапию антиоксидантов и пептидных биорегуляторов.
Апробация работы и личный вклад автора:
Основные положения диссертации опубликованы в печати (21 печатных работ, из которых 12 в журналах, включенных в перечень ВАК и 1 методическая разработка). Результаты доложены на научно-практической конференции «Невынашивание беременности и недоношенный ребенок» (Петрозаводск, 2002), на Международном Экологическом Форуме «Environment and human health» (Санкт-Петербург, 2003) на III Российском конгрессе «Современные технологии в пелиатрии и детской хирургии» (Москва, 2003), на I Евро-Азиатском конгрессе «The Events of the year in Gynecology and Obsterics» (Санкт-Петербург, 2004), на IV Всероссийском форуме «Мать и дитя» (Москва, 2004), на научно-практической конференции «50 лет мелатонину: итоги и перспективы исследований» (Санкт-Петербург, 2008).
Анализ соматического здоровья, течения беременности и родов у матерей, обследование новорожденных детей, определение уровня экскреции
Объем и структура диссертации:
Диссертация изложена на 184 страницах машинописного текста и состоит из введения, обзора литературы, характеристики материала и методов исследования, результатов собственных исследований, выводов, практических рекомендаций и списка литературы. Работа иллюстрирована 34 таблицами и 10 рисунками. Список литературы включает 417 источников, из них 174 отечественных и 243 иностранных авторов.
СОДЕРЖАНИЕ РАБОТЫ
МАТЕРИАЛЫ И МЕТОДЫ
С целью изучения частоты рождения детей с ЗВУР проведен анализ материала отчетов о работе в
Для выяснения гестационного возраста детей с различной степенью ЗВУР проведен анализ 293 историй родов и развития новорожденных, имевших ЗВУР.
С целью изучения влияния материнской соматической патологии и осложнений беременности на формирование функций ЦНС проведена оценка ранней неонатальной адаптации, состояния позотонических и рефлекторных реакций у 115 новорожденных детей, у которых причиной ЗВУР явилось осложнение беременности гестозом. Дети родились на сроке ≥36 недель. Известно, что к этому сроку завершаются процессы формирования циклической организации поведенческих состояний, постурального, активного и пассивного тонуса, а также рефлекторных реакций, что создает возможность объективной оценки соответствия функциональной зрелости ЦНС гестационному возрасту ребенка. Были сформированы следующие группы:
I группа — 39 пар мать-ребенок (дети с симметричной формой ЗВУР); новорожденные дети с диспластическим вариантом симметричной формы ЗВУР в исследование не включали;
II группа — 52 пары (дети с асимметричной формой ЗВУР, гипотрофия II степени);
III группа — 24 пары (дети с асимметричной формой ЗВУР, гипотрофия
Контрольную группу составили 30 матерей и их здоровые доношенные новорожденные дети.
Критерии исключения:
- дети с пороками развития и стигмами дизэмбриогенеза;
- дети от матерей с сахарным диабетом;
- дети с клиническим проявлением внутриутробной инфекции;
- дети от матерей с никотиновой интоксикацией.
Характер и степень ЗВУР определяли согласно классификации, приведенной в национальном руководстве, и с помощью центильных таблиц (Дементьева Г.М., 1981; Ильин Б.Н., 1975).
Соответствие развития постурального, пассивного, активного тонуса рефлекторных реакций должным для данного гестационного возраста определяли в
Наряду с этим, на
Клиническое состояние детей оценивали при рождении и в течение раннего неонатального периода в сопоставлении с результатами инструментальных (ЭКГ, ЭхоКГ, нейросонография, рентгенография) и лабораторных исследований (клинический анализ крови, показатели кислотно-основного равновесия, уровень сахара и билирубина, крови), а также микробиологических и вирусологических исследований, включавших выявление грамотрицательной и грамположительной флоры, микоплазм, хламидий, вирусов простого герпеса и цитомегалии.
Продолжительность и тяжесть внутриутробного страдания плода оценивали на основании изучения соматического и акушерско-гинекологического анамнеза матери, особенностей течения настоящей беременности и родового акта. Материалы для анализа были получены из обменных карт и историй родов матерей, которые находились под наблюдением специалистов НИИ АГ им. Д.О. Отта СЗО РАМН.
Проводили гистологическое исследование последов и определение экспрессии мелатонина в плаценте методом непрямой иммунофлюоресценции с применением специфической антисыворотки (CID tech. Res. Inc., Канада).
Изучали состояние свободнорадикального окисления и антиоксидантной защиты у 73 детей основной и у 50 новорожденных контрольной группы на основании определения интенсивности ПОЛ и общей антиокислительной активности методом хемилюминесценции. Антирадикальную активность крови определяли, используя стабильные радикалы
С целью выяснения степени нарушений целостности биомембран нейронов и кардиомиоцитов вследствие хронической гипоксии определяли активность мозгового и сердечного изоферментов креатинкиназы на основании выявления В-субъединиц с помощью поликлональных антител к М-СК мономеру фермента («Konelab», Финляндия). Забор крови проводили в первые 6 часов жизни ребенка.
Продукцию мелатонина у детей основании определения уровня экскреции
Общее количество обработанного различными методами материала привелено в таблице 1.
Таблица 1
Общее количество исследований, проведенных различными методами
| Методики | Группы | ||
|---|---|---|---|
| Основная | Контрольная | Всего | |
| Анализ соматического здоровья, течения настоящей беременности и родов у матери | 115 | 30 | 145 |
| Клиническая оценка состояния новорожденного ребенка | 115 | 30 | 145 |
| Оценка позотонических и рефлекторных реакций | 115 | 30 | 145 |
| Гистологическое исследование плаценты | 115 | 30 | 145 |
| Гистохимическое исследование плаценты (определение экспрессии мелатонина) | 13 | 10 | 23 |
| Нейросонографическое исследование | 109 | 30 | 139 |
| Электрополиграфическое исследование сна | 10 | 10 | 20 |
| ЭКГ | 51 | 30 | 81 |
| ЭхоКГ исследование | 18 | 30 | 48 |
| Определение
ПОЛ АРА ОАА |
73
73 73 |
50
50 50 |
123
123 123 |
| Определение креатинкиназы
общей сердечного изофермента мозгового изофермента |
28
28 28 |
10
10 10 |
38
38 38 |
| Определение дневной и ночной порциях мочи |
15
15 |
10
9 |
25
24 |
Статистическую обработку результатов проводили с использованием методов параметрической и непараметрической статистики. Методы описательной статистики включали в себя среднюю арифметическую величину (М), среднее квадратичное отклонение (σ) и среднюю ошибку средней величины (m).
Достоверность различий между средними величинами параметров определяли с помощью t-критерия Стьюдента, а для независимых и малых выборок использовали критерий U (непараметрический критерий Манна-Уитни), для сравнения относительных величин — критерий F (точный критерий Фишера). Корреляционный анализ проводили с использованием параметрического критерия Пирсона, а для малых выборок — непараметрического критерия Спирмана. Составление специальных электронных таблиц и оформление, а также статистическую обработку материала проводили с использованием персонального компьютера Intel Celeron 2,5 GHz с помощью программных пакетов «Microsoft Office 2003», «SPSS 13.0».
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Анализ материала отчетов о работе отделения физиологии и патологии новорожденных детей НИИ АГ им. Д.О. Отта СЗО РАМН за
Так, среди доношенных новорожденных дети с ЗВУР составляют 2,7 ± 0,4% — 4,9 ± 0,5%, тогда как среди недоношенных их частота колеблется от 30,6 ± 4,4% до 49,2 ± 0,5%. Мы попытались выяснить каков гестационный возраст детей с различной степенью ЗВУР.
Для этого 293 ребенка с ЗВУР, родившиеся в
Таблица 2
Гестационный возраст новорожденных с различной степенью ЗВУР
| Группы |
Возраст (недель) |
|||
| ≤32 | ≥37 | |||
| I
n=99 |
8,1 ± 2,7%
(8) |
18,2 ± 3,9%
(18) |
19,2 ± 4,0%
(19) |
54,5 ± 5,0%
(54) |
| II
n=108 |
5,6 ± 2,2%
(6) |
4,6 ± 2,0%
(5) |
13,0 ± 3,2%
(14) |
76,9 ± 4,1%
(83) |
| III
n=86 |
2,3 ± 1,6%
(2) |
9,3 ± 3,1%
(8) |
27,9 ± 4,8%
(24) |
60,5 ± 5,3%
(52) |
Из таблицы видно, что среди новорожденных с симметричной формой ЗВУР высок процент недоношенных детей. Наряду с этим более половины из числа родившихся с ЗВУР составляют доношенные дети, у которых кроме задержки массы тела и роста относительно должных для гестационного возраста величин наблюдалось отставание функционального развития. Известно, что при нормальных условиях внутриутробного развития уже к
Анализ соматического здоровья у матерей новорожденных детей с ЗВУР показал высокую частоту патологии различных функциональных систем. Преобладали хронические заболевания мочеполовой, эндокринной, сердечно-сосудистой систем, желудочно-кишечного тракта (табл. 3).
Таблица 3
Частота патологии различных функциональных систем у матерей новорожденных детей с ЗВУР
| Заболевания | Группы | |||
| I
(n = 39) |
II
(n = 52) |
III
(n = 24) |
Контроль
(n = 30) |
|
| Эндокринной системы | 53,9 ± 8,0%
(21)*** |
17,3 ± 5,2%•••
(9) |
25,0 ± 8,8%•
(6) |
13,3 ± 6,2%
(4) |
| Сердечно-сосудистой системы | 43,6 ± 7,9%
(17) |
30,8 ± 6,4%
(16) |
41,7 ± 10,1%
(10) |
(0) |
| Желудочно-кишечного тракта | 20,5 ± 6,5%
(8) |
5,8 ± 3,2%
(3) |
4,2 ± 4,1%
(1) |
(0) |
| Мочеполовой системы | 82,1 ± 6,2%
(32)*** |
59,6 ± 6,8%•
(31)** |
37,5 ± 9,9%•••
(9) |
26,7 ± 8,1%
(8) |
| Анемия | 25,6 ± 7,0%
(10) |
13,5 ± 4,7%
(7) |
20,8 ± 8,3%
(5) |
10,0 ± 5,5%
(3) |
| Аллергические заболевания | 20,5 ± 6,5%
(8) |
15,4 ± 5,0%
(8) |
16,7 ± 7,6%
(4) |
(0) |
Примечание: * — p < 0,05; ** — p < 0,01; *** — p < 0,001 — достоверность различий показателей по сравнению с контрольной группой. • — p < 0,05; •• — p < 0,01; ••• — p < 0,001 — достоверность различий показателей по сравнению с I группой.
Индивидуальный анализ показал, что сочетание патологии нескольких функциональных систем организма имеет место у 61,5% матерей детей с симметричной формой ЗВУР, а также у 11,6% матерей II и 16,7% — III группы.
При изучении акушерского анамнеза у женщин с патологией нескольких функциональных систем отмечена высокая частота преждевременных родов (20,5 ± 6,5%) и самопроизвольных выкидышей (15,4 ± 5,8%). Угроза прерывания настоящей беременности наблюдалась у каждой третьей женщины на ранних сроках и у каждой второй во второй ее половине (табл. 4).
Из таблицы видно, что у женщин, родивших детей с ЗВУР высока частота гестоза, причем только у беременных I и II групп наблюдалось более тяжелое его течение.
В родах у каждой второй беременной, имевшей патологию трех и более функциональных систем, произошло преждевременное излитие околоплодных вод, а у каждой третьей наблюдалась аномалия родовой деятельности, что определило высокую частоту оперативного родоразрешения. В первой группе оно составило 51,3% (в норме 16,7%, р < 0,01), а во второй — 42,3% (p < 0,05).
Таблица 4
Частота осложнений беременности у женщин, родивших детей с ЗВУР
| Осложнения | Группы | |||
| I
(n = 39) |
II
(n = 52) |
III
(n = 24) |
Контроль
(n = 30) |
|
| Угроза прерывания в I половине беременности | 33,3 ± 7,6%
(13) |
30,8 ± 6,4%
(16) |
20,8 ± 8,3%
(5) |
(0) |
| Угроза прерывания во II половине беременности | 53,9 ± 8,0%*
(21) |
55,8 ± 6,9%**
(29) |
50,0 ± 10,2%
(12) |
26,7 ± 8,1%
(8) |
| Гестоз
— преэклампсия |
69,2 ± 7,4%
(27) 12,8 ± 5,3 (5) |
57,7 ± 6,8%
(30) 3,9 ± 2,7 (2) |
45,8 ± 10,2%
(11) (0) |
(0)
(0) |
Примечание: * — p < 0,05; ** — p < 0,01; *** — p < 0,001 — достоверность различий показателей по сравнению с контрольной группой.
Анализ результатов гистологического исследования плацент выявил наиболее высокую частоту субкомпенсированной хронической плацентарной недостаточности в сочетании с патологической незрелостью ворсин хориона у матерей, дети которых имели симметричную форму ЗВУР (табл. 5).
Таблица 5
Показатели гистологического исследования плацент матерей, дети которых имели ЗВУР
| Признак | Группы | |||
| I
(n = 39) |
II
(n = 52) |
III
(n = 24) |
Контроль
(n = 30) |
|
| Высокая степень инволютивно-дистрофических изменений | 56,4 ± 7,9%•
(22) |
48,1 ± 6,9%•
(25) |
41,7 ± 10,1%
(10) |
26,7 ± 8,1%
(8) |
| Высокая степень фиброза | 61,6 ± 7,8%
(24)••• |
55,8 ± 6,9%••
(29) |
37,5 ± 9,9%
(9) |
20,0 ± 7,3%
(6) |
| Низкая степень компенсаторно-приспособит. реакций | 18,0 ± 6,2%
(7) |
13,5 ± 4,7%
(7) |
8,3 ± 5,6%
(2) |
(0) |
| Значительные циркуляторные нарушения | 48,7 ± 8,0%•
(19) |
48,1 ± 6,9%•
(25) |
50,0 ± 10,2%•
(12) |
23,3 ± 7,7%
(7) |
| Воспалительные изменения в плаценте | 74,4 ± 7,0%
(29)•• |
59,6 ± 6,8%
(31) |
50,0 ± 10,2%
(12) |
43,3 ± 9,0%
(13) |
| Патологическая незрелость плаценты | 92,3 ± 4,3%
(36) |
42,3 ± 6,9%***
(22) |
45,8 ± 10,2%***
(11) |
(0) |
| Субкомпенсированная ХПН | 100%
(39) |
42,3 ± 6,9%***
(22) |
41,7 ± 10,1%***
(10) |
(0) |
Примечание: * — p < 0,05; ** — p < 0,01; *** — p < 0,001 — достоверность различий показателей по сравнению с I группой.
• — p < 0,05; •• — p < 0,01; ••• — p < 0,001 — достоверность различий показателей по сравнению с контрольной группой.
При этом наблюдалась высокая степень инволютивно-дистрофических изменений и низкий уровень компенсаторно-приспособительных реакций.
Известно, что в патогенезе хронической плацентарной недостаточности большую роль играет эндотелиальная дисфункция, в основе которой лежит активация свободнорадикального окисления и нарушение молекулярных механизмов клеточной регуляции (Аржанова О.Н. и др., 2000; Мозговая Е.В. и др., 2003; Walsh S.W., Wang Y., 1993; Ertan A.K. et al., 2004). Изменения в системе циклических нуклеотидов и других биохимических регуляторов уже в первом триместре беременности сказываются на многих биохимических процессах, происходящих в органе, и их особенностях в условиях осложненной беременности (Погорелова Т.Н. и др., 1997).
Результаты наших исследований показали, что нарушение развития плаценты (патологическая незрелость) и формирование хронической плацентарной недостаточности имеет место всегда при наличии у беременной совокупности хронической патологии нервной, эндокринной и иммунной систем. Это дает основание полагать, что у данного контингента женщин имеется неполноценность диффузной нейроиммуноэндокринной системы (ДНИЭС), состояние которой определяет не только наступление беременности, но и морфофункциональное развитие плаценты и плода (Кветной И.М. и др., 2005; Пальчик А.Б., 2000; Bartsch C., 1997). Классические пептидные гормоны (хориональный гонадотропин, пролактин, кортикотропный рилизинг-гормон, лептин, соматостатин, эндотелины), белки-мессенджеры (синцитин, эндоглин, цитокин), биогенные амины (серотонин, мелатонин, гистамин, катехоламины), внутри- и межклеточные сигнальные молекулы (цитокины, нейропилины, интегрины, хемокины, хапероны и многие другие) регулируют функцию плаценты и тем самым влияют на процесс морфофункционального развития плода. Одним из наиболее изученных биогенных аминов ДНИЭС является мелатонин. В плаценте при нормальном ее развитии он продуцируется и депонируется в структурных элементах ворсинчатого хориона: синцитиотрофобласте, синцитиокапиллярных мембранах, синцитиальных узлах, единичных клетках стромы и эндотелии сосудов (Li R.H. et al., 1991; Malassine A., Cronier L., 2002; Лапина Е.А., 2004).
Результаты наших исследований показали, что в плацентах матерей, родивших здоровых доношенных детей, площали экспрессии мелатонина в центральной и периферической областях плаценты равны и составляют соответственно 9,38 ± 1,32% и 8,7 ± 1,52% (p >0,05). Площади интенсивного свечения (>2,2 опт. ед.) также одинаковы в центральной части плаценты и на периферии (1,34 ± 0,13% и 1,13 ± 0,16%, p >0,05).
Экспрессия мелатонина в плаценте возрастает при хронической плацентарной недостаточности, причем достоверное увеличение площади экспрессии наблюдается при субкомпенсированной плацентарной недостаточности и наличии у ребенка ЗВУР (табл. 6).
Таблица 6
Распределение площади экспрессии мелатонина в зависимости от тяжести плацентарной недостаточности
| Группы |
Площадь экспрессии (%) |
|
| Центр | Периферия | |
| Субкомпенсированная ХПН | 14,43 ± 0,79* | 7,73 ± 3,47 |
| Компенсированная ХПН | 12,21 ± 0,64 | 8,61 ± 2,44 |
| Контрольная | 9,38 ± 1,32 | 8,70 ± 1,52 |
Примечание: * — p = 0,006 — достоверность различий показателя с таковым в контрольной группе.
Наряду с этим возрастает оптическая плотность свечения: 2.6 у.е. против 1,66 у.е. при компенсированной форме хронической плацентарной недостаточности (р = 0,04) и 1,34 у.е. в контроле (р = 0,03). Это свидетельствует о значительном накоплении мелатонина на единице площади.
Увеличение представленности мелатонина, коррелирующее с тяжестью плацентарной недостаточности, является компенсаторной реакцией в условиях возникающего при плацентарной недостаточности дисбаланса системы СРО/АОЗ. Известно, что мелатонин является мощным поглотителем свободных радикалов, активирует глутатионпероксидазу в хорионе и регулирует активность NO-синтаз (Okatani Y. et al., 2001; Teixeira A. et al., 2003). Выявленное нами увеличение экспрессии мелатонина в плаценте при хронической субкомпенсированной плацентарной недостаточности, сочетающееся с наличием ЗВУР плода, может быть обусловлено повышением его синтеза мелатонин продуцирующими клетками, а также, возможно, переносом этого гормона в плаценту из организми матери и плода. Известно, что при наличии хронической плацентарной недостаточности и синдрома задержки внутриутробного развития плода в крови беременных содержание мелатонина снижено (Okatani Y. et al., 1998; K. Watanabe et al., 2004; Xu D.X. et al., 2007). У новорожденных детей с тяжелой степенью ЗВУР значительно снижено содержание мелатонина в тромбоцитах, которые в норме вырабатывают до 40% внеэпифизарного мелатонина и переносят его в нужное место в нужное время (Kvetnoy I.M., 1999, 2002; Третьякова М.Б., 2006). Благодаря повышенному содержанию мелатонина в плаценте создаются условия для поддержания ее функции и сохраниния жизнеспособности внутриутробного плода. Однако при этом у ребенка нарушается генетическая программа морфофункционального развития, что проявляется не только в остановке роста и массы, но и в отставании формирования функций ЦНС.
Анализ состояния при рождении и в первые дни жизни ребенка постурального, пассивного и активного тонуса, а также рефлекторных реакций показал высокую частоту отставания развития функций, особенно среди родившихся с симметричной формой ЗВУР (табл. 7).
Таблица 7
Частота задержки формирования постурального, пассивного и активного тонуса и физиологических рефлексов у новорожденных с ЗВУР
| Тип задержки | Группы | ||
| I
(n = 32) |
II
(n = 41) |
III
(n = 24) |
|
| Равномерная на 2 нед. | 37,5 ± 8,6%
(12) |
14,6 ± 5,5%*
(6) |
8,3 ± 5,6%*
(2) |
| Равномерная на 4 нед. | 25,0 ± 7,6%
(8) |
9,8 ± 4,6%
(4) |
4,2 ± 4,1%
(1) |
| Диссоциированная | 12,5 ± 5,9%
(4) |
7,3 ± 4,1%
(3) |
|
| Всего | 75,0 ± 7,7%
(24) |
31,7 ± 7,3%***
(13) |
12,5 ± 6,7%***
(3) |
Примечание: * — p < 0,05; ** — p < 0,01; *** — p < 0,001 — достоверность различий показателей по сравнению с I группой.
При этом диссоциированная задержка формирования тонических и рефлекторных реакций нами выявлена только у детей с тяжелой симметричной и асимметричной формами ЗВУР.
Известно, что становление тонических и рефлекторных реакций в раннем онтогенезе идет параллельно с формированием циклической организации сна (Фоменко Б.А., 1995).
Результаты наших электрополиграфических исследований показали, что задержка позотонических и рефлекторных реакций сочетается с нарушением формирования циклической организации сна.
В тех случаях, когда у детей с ЗВУР позотонические и рефлекторные реакции соответствуют гестационному возрасту, наблюдается укорочение длительности ортодоксальной и парадоксальной фаз сна, но соотношение между ними сохраняется с преимущественной представленностью парадоксальной фазы (табл. 8).
Таблица 8
Продолжительность фаз и цикла сна у детей с ЗВУР, функциональное развитие ЦНС которых соответствовало их гестационному возрасту
| Группы | Продолжительность (мин) | ||
| Цикл сна | Ортодоксальная фаза | Парадоксальная фаза | |
| Основная (n = 3) | 37,7 ± 1,5 | 14,0 ± 1,9 | 23,6 ± 0,5 |
| Контрольная (n = 10) | 63,4 ± 3,9 | 27,3 ± 1,7 | 36,1 ± 2,3 |
| p | 0.0003 | 0,04 | 0.0004 |
Примечание: достоверность различий показателей определяли по U-критерию Манна-Уитни.
Однако наблюдаются существенные качественные изменения сна. Так, во время ортодоксальной фазы на ЭЭГ наблюдается снижение амплитуды дельта волн (22,4 ± 0,4 мкВ против 34,0 ± 2,1 мкВ в норме, р < 0,001) и тета волн (10,9 ± 0,04 мкВ против 16,1 ± 0,9 мкВ, р < 0,01). Высока частота глазодвигательных реакций и обусловленных ими активаций. В то же время общая двигательная активность выражена в меньшей степени и составляет всего 6,4% от общей длительности фазы, тогда как в норме 12%.
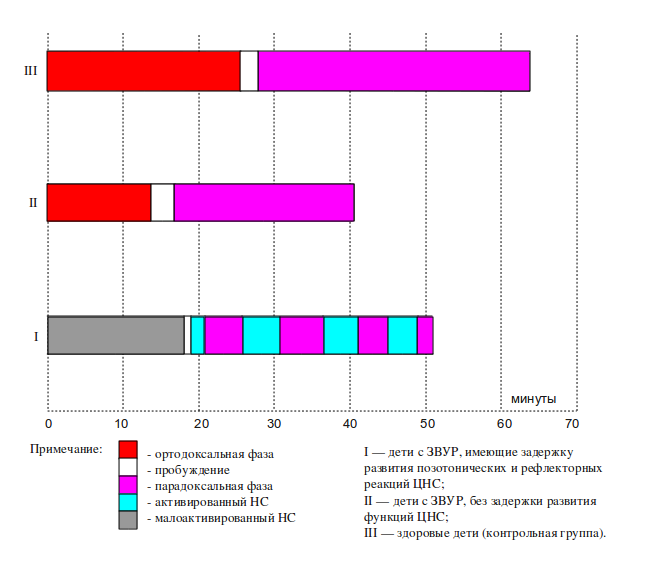
При наличии у ребенка ЗВУР и диссоциированного отставания позотонических и рефлекторных реакций циклическая организация сна отсутствует. Регистрируются фрагменты сна, близкие по характеру вегетативных и двигательных реакций ортодоксальному или парадоксальному сну, однако при этом нет корреляции с биоэлектрической активностью мозга. Недифференцированный сон часто прерывается криком и пробуждениями ребенка (рис.1) .
Рис. 1. Циклическая организация сна у детей с ЗВУР
Отсутствие циклической организации сна у доношенных новорожденных детей рассматривается как свидетельство функциональной незрелости ЦНС или следствие повреждающего воздействия гипоксии на развивающийся мозг (Евсюкова И.И., 1973; Кожатов А.Д., 1990; Фоменко Б.А., 1995; Gertner S. et al., 2002). Можно полагать, что отмеченные нами изменения продолжительности цикла сна обусловлены особенностями обмена биогенных аминов — серотонина и норадреналина (Евсюкова И.И., 1973). В то же время наличие диссоциации позотонических и рефлекторных реакций в сочетании с отсутствием циклической организации сна указывает на поражение мозговых структур на клеточном и субклеточном уровнях.
Известно, что одним из основных повреждающих воздействий в условиях длительной гипоксии является активация СРО (Дещекина М.Ф. и др., 1989; Ergin H. et al., 2001; Mishra O.P. et al., 2006).
Результаты наших исследований показали, что при субкомпенсированной хронической плацентарной недостаточности и наличии у ребенка симметричной или тяжелой асимметричной формы ЗВУР (гипотрофия III степени) наблюдается снижение антирадикальной активности (АРА) и увеличение общей антиокислительной активности (ОАА) (табл. 9). Корреляционная связь этих показателей с интенсивностью ПОЛ отсутствует.
Таблица 9
Показатели процессов ПОЛ, АРА и ОАА в первый день жизни у детей с различной степенью ЗВУР
| Группы | Показатели | ||
| ПОЛ
(ХЛ мВ) |
АРА
(мкмоль/л) |
ОАА
(мл-1 сыворотки) |
|
| Симм. ЗВУР + Асимм. ЗВУР (гипотрофия III) n = 29 | 10,0 ± 0,1 | 845,9 ± 16,0*** | 0,296 ± 0,03* |
| Асимм. ЗВУР (гипофтрофия n = 11 |
9,4 ± 1,3 | 938,6 ± 33,3 | 0,221 ± 0,02 |
| Здоровые дети
n = 50 |
10,5 ± 0,6 | 945,0 ± 19,1 | 0,223 ± 0,01 |
Примечание: достоверность различий показателей у детей контрольной группы: * — p < 0,05; ** — p < 0,01; *** — p < 0,001.
Поскольку мощным поглотителем свободных радикалом является мелатонин, представлялось интересным выяснить уровень его продукции в организме ребенка. Кроме того известно, что мелатонин как нейротрансмиттер, играет большую роль в формировании синаптических связей, а, следовательно, и в развитии функций ЦНС, в том числе и становлении циклической организации сна (Jan J.E. et al., 1999; Drew J.E. et al., 2001; Husson I. et al., 2002).
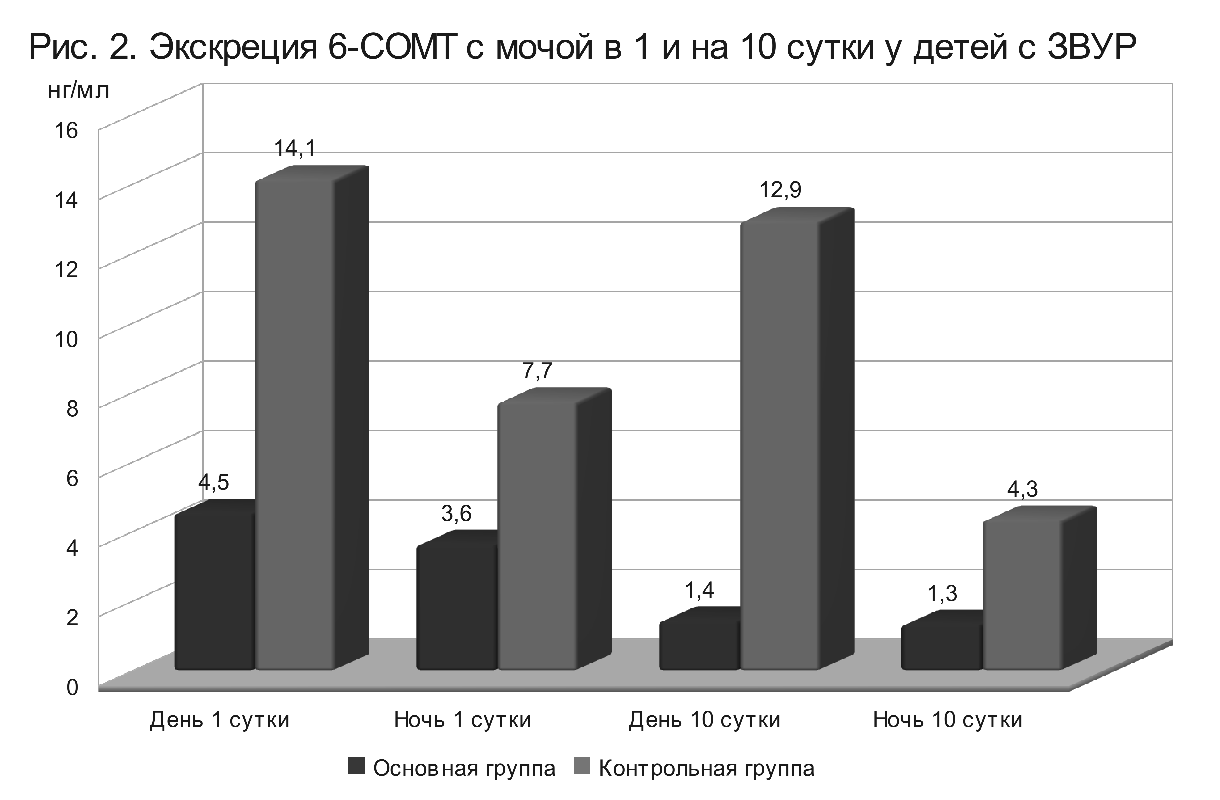
Результаты исследований показали, что у новорожденных детей, внутриутробное развитие которых протекало в условиях субкомпенсированной хронической плацентарной недостаточности, уровень экскреции с мочой
В отличие от здоровых новорожденных, у которых продукция мелатонина в дневное время суток выше, чем ночью, у детей с ЗВУР суточный ритм отсутствует, продукция мелатонина одинаково низкая в дневные и ночные часы.
Рис. 2. Экскреция 6СОМТ с мочой в 1 и на 10 сутки у детей с ЗВУР
Индивидуальный анализ показал, что наиболее низкие показатели уровня экскреции
Известно, что продукция биогенных аминов и других пептидов в раннем онтогенезе человека существенно превыщает таковую в последующие периоды его жизни (Евсюкова И.И., 2006).
Вероятно, снижение продукции мелатонина в организме новорожденного при тяжелой форме ЗВУР связано прежде всего с возрастанием его потребления в условиях истощения других антиоксидантов (Reiter R.J. et al., 1995; Bartsch C. et al., 1997; Okatani Y. et al., 2001; Zwirska-Korczala K. et al., 2005). Вместе с тем, большую роль играет обусловленное длительным воздействием гипоксии нарушение рецепторного аппарата клеток, что сожет вести к нарушению захвата серотонина и синтеза мелатонина в клетках ДНИЭС (Додхоев Д.С., 1999; Петрушина А.Д. и др., 2000). Не исключена возможность переноса мелатонина в плаценту тромбоцитами плода.
При недостатке мелатонина в крови повышается активность циклооксигеназы тромбоцитов и продукция тромбоксана В2, что способствует повышению их функциональной активности (Третьякова М.Б., 2006). Кроме того, возрастает активность NO-синтазы и снижается уровень глутатионпероксидазы, что приводит к избыточному образованию свободных радикалов, повышению пероксинитрита и ПОЛ (Guerrero J.M. et al., 1997; Reiter R.J., Maestroni G.J.M., 1999; Wakatsuki A. et al., 2001; Xue-June Li et al., 2002). Это способствует вазоконстрикции, тромбообразованию, повышению вязкости крови и ведет к нарушению микроциркуляции в тканях и органах, возникновению ишемических поражений. Все эти факторы лежат в основе нарушения постнатальной адаптации данного контингента детей. Результаты наших исследований показали, что большинство новорожденных имели неврологические нарушения в виде синдрома повышенной возбудимости (нарушение сна и двигательной активности до
Анализируя особенности ранней постнатальной адаптации, состояние ЦНС у детей с ЗВУР мы отметили существенные нарушения постнатальной перестройки гемодинамики. У них длительно отмечался периоральный и акроцианоз, «мраморный рисунок» кожных покровов, приглушенность сердечных тонов и систолический шум. На ЭКГ определяли признаки повышения электрической активности правых отделов сердца, нарушение проведения по типу неполной блокады правой ножки пучка Гиса, обменные нарушения в миокарде. Эхокардиографические исследования выявили у каждого третьего ребенка дилатацию правого желудочка и снижение сократительной способности миокарда левого желудочка (табл. 10).
Таблица 10
Показатели у детей с ЗВУР гипокинетического типа гемодинамики
| Группы | Показатели | ||||||
| Vд | Vc | УО | МОК | ФИ | ФУ | УПС | |
| Основная
(n = 9) |
7,6 ± 0,3 | 3,2 ± 0,4 | 4,0 ± 0,2 | 489,1 ± 25,8 | 55,9 ± 2,3 | 26,7 ± 1,4 | 20,3 ± 1,0 |
| Контрольная
(n = 4) |
10,2 ± 0,3 | 5,4 ± 0,6 | 6,0 ± 0,2 | 742,8 ± 21,7 | 60,4 ± 3,2 | 35,5 ± 2,5 | 15,5 ± 1,0 |
| p | < 0,001 | < 0,01 | < 0,001 | < 0,001 | > 0,05 | < 0,01 | < 0,01 |
Примечание: Vд — конечно-диастолический объем левого желудочка (ЛЖ) (мл); Vс — конечно-систолический объем ЛЖ (мл); УО — ударный объем; МОК — минутный объем крови (мл); ФИ — фракция изгнания (%); ФУ — фракция укорочения (%); УПС — удельное периферическое сопротивление (усл. ед); Р — частота сердечных сокращений (уд/мин). Достоверность определялась по U-критерию Манна-Уитни.
В основе выявленных патологических состояний могут лежать изменения на клеточном уровне. В связи с этим мы изучили активность мозгового и сердечного изоферментов креатинкиназы у новорожденных детей с задержкой внутриутробного развития.
Результаты наших исследований показали, что у всех детей с ЗВУР активность мозгового изофермента креатинкиназы имеет тенденцию к повышению (табл. 11).
Таблица 11
Показатели активности общей креатинкиназы (СК), ее мозгового (СК-ВВ) и сердечного изоферментов (СК-МВ) у новорожденных детей с различными формами ЗВУР
| Группы детей | Показатели | ||
| Общая СК (Ед/л) | СК-МВ (Ед/л) | СК-ВВ (Ед/л) | |
| Симметричная ЗВУР | 709,6 ± 196,4 | 142,3 ± 50,8 | 12,1 ± 2.8 |
| Асимметричная ЗВУР | 669,9 ± 205,9 | 81,4 ± 15,3 | 11,2 ± 3,3 |
| Контрольная группа | 480,3 ± 77,7 | 77,5 ± 15,2 | 8,2 ± 0,7 |
Значительное (более чем в 2 раза) повышение активности мозгового изофермента креатинкиназы, превышающее показатели, характерные для здоровых детей, наблюдается в случае наличия у ребенка сопутствующего внутриутробного инфицирования (20,9 ± 3,6 Ед/л против 8,2 ± 0,7 Ед/л в норме, р=0,005).
Известно, что уровень активности мозгового изофермента креатинкиназы при тяжелых неврологических нарушениях значительно превышает нормальные величины (Арутюнян А.В. и др., 1996; Айламазян Э.К., 1998. 1999; Pavlova N.G. et al., 1999). Он является внутриклеточным энзимом, находящимся в нейронах и астроцитах, поэтому повышение его уровня в крови может свидетельствовать о нарушении целостности биологических мембран (Worley G. et al., 1985).
Подобные изменения характерны не только для клеток ЦНС, но и для других органов плода, развивающегося в условиях гипоксии. Активность сердечного изофермента креатинкиназы также имеет тенденцию к повышению (табл. 11). При этом, чем выше была активность сердечного изофермента креатинкиназы, тем в большей степени отмечалоь снижение сократительной способности миокарда левого желудочка (rфи/ск-мв = −0,6 (р=0,02), rфу/ск-мв = −0,52 (p=0,03)), что может свидетельствовать о нарушении функции кардиомиоцитов в результате повреждения их мембран.
Задержка функционального развития ЦНС, особенно ее интегративной функции, а также замедленная перестройка гемодинамики являются причиной неврологических и гемодинамических нарушений в процессе адаптации ребенка к новым условиям окружающей среды.
Таким образом, на основании результатов комплексных клинических обследований матери и новорожденного ребенка в сопоставлении с данными гистологического исследования плаценты и экспрессии в ней мелатонина, а также исследований состояния ПОЛ, ОАА, АРА, нейроспецифического и сердечного изофермента креатинкиназы в сопоставлении с экскрецией
Схема 1
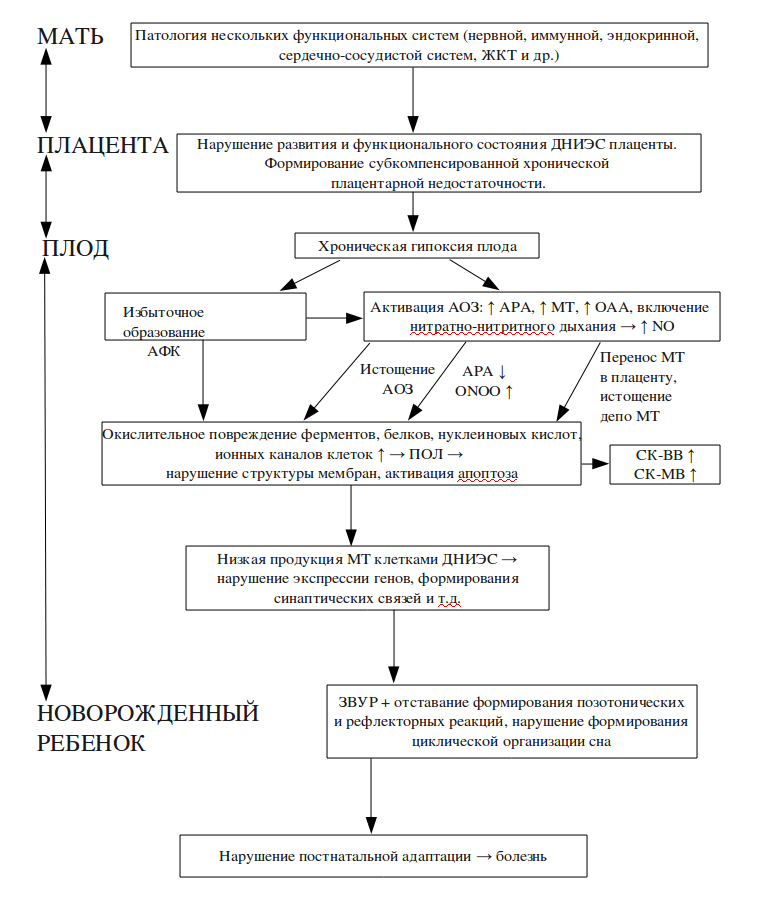
Наличие у женщин патологии нескольких функциональных систем организма (в первую очередь нервной, эндокринной, иммунной и т. д.) свидетельствует о нарушении состояния ДНИЭС.
В условиях недостаточности ДНИЭС организма создаются предпосылки для нарушения нормального развития и функционирования плаценты, в частности, ее ДНИЭС. Неблагоприятные воздействия окружающей среды, равно как осложнение беременности гестозом и/или активация хронических воспалительных заболеваний инициируют раннее формирование хронической плацентарной недостаточности.
В физиологических условиях по мере прогрессирования беременности происходит постепенное развитие компенсаторно-приспособительных реакций. При воздействии патологических факторов, прежде всего, возникают морфологические изменения, направленные на обеспечение гемодинамических приспособительных реакций в системе мать-плацента-плод. Однако при нарушении закономерного морфофункционального созревания плаценты затрудняется развитие адекватной компенсаторной реакции плацентарного барьера, что служит основанием для срыва адаптационных механизмов фетоплацентарной системы. В результате нарушается транспортная, трофическая, эндокринная и метаболическая функции плаценты, т. е. формируется субкомпенсированная хроническая плацентарная недостаточность с характерным для нее синдромом задержки внутриутробного развития плода.
В условиях длительной хронической гипоксии в организме плода происходит активация процессов свободнорадикального окисления. Одновременно активируются компенсаторно-приспособительные процессы, направленные на использование в этих условиях филогенетически древних механизмов антиоксидантной защиты. В первую очередь активируются нитритредуктазные системы, связанные с гемсодержащими белками. Дефицит кислорода является сигналом для перехода на нитратно-нитритное дыхание, в условиях которого увеличивается продукция оксида азота, который выступает как регулятор и ограничитель окислительных реакций.
Однако в условиях продолжающейся гипоксии расход низкомолекулярных антиоксидантов, взаимодействующих с органическими радикалами и блокирующих цепные окислительные реакции, превышает их биосинтез, что приводит к истощению антирадикальной активности и активации перекисного окисления липидов. Следствием этого является окислительное повреждение ферментов, белков, нуклеиновых кислот, ионных каналов клетки. В результате нарушается захват серотонина и снижается продукция мелатонина тромбоцитами и другими клетками ДНИЭС.
Избыточное потребление мелатонина в условиях снижения способности мелатонин продуцирующих клеток к его воспроизводству, а также возможный переход мелатонина в плаценту приводят к низкому его уровню в организме ребенка. Создаются условия, в которых дефицит такого важного для развития ЦНС нейротрансмиттера, регулятора клеточной пролиферации и межклеточных взаимодействий, модулятора нейроиммуноэндокринных взаимоотношений ведет к задержке экспрессии генов, и, как следствие — задержке функционального развития ЦНС, интенсивность которого максимальна в перинатальный период онтогенеза. Задержка тонических и рефлекторных реакций и формирования такой важной для психомоторного развития ребенка функции как циклическая организация сна, в частности, парадоксальной фазы сна, влечет за собой нарушение осуществления при переходе в новые условия окружающей среды адекватных адаптивных реакций всех органов и систем, а также способствует возникновению расстройств гомеостаза.
Полученные данные являются основанием для прогноза развития хронической плацентарной недостаточности у беременных и синдрома задержки внутриутробного развития. Установлены объективные клинические (оценка позотонических и рефлекторных реакций), нейрофизиологические (оценка формирования циклической организации сна) и биохимические критерии
ВЫВОДЫ
- У женщин, имеющих патологию нескольких функциональных систем организма (нервной, иммунной, эндокринной, сердечно-сосудистой, ЖКТ, мочеполовой), во время беременности рано формируется субкомпенсированная плацентарная недостаточность, наблюдается несоответствие зрелости плаценты сроку гестации, возникают осложнения беременности (угроза прерывания беременности, тяжелые формы гестоза) и родового акта (аномалии родовой деятельности). Чем больше тяжесть патологичских изменений плаценты, тем больше степень ЗВУР ребенка.
- При наличии патологической незрелости плаценты и формирования субкомпенсированной хронической плацентарной недостаточности в плаценте увеличена экспрессия мелатонина, что является защитной компенсаторной реакцией, направленной на сохранение структуры и функции этого органа, необходимого для поддержания жизнеспособности плода.
- При наличии патологической незрелости плаценты и субкомпенсированной хронической плацентарной недостаточности у новорожденных детей наблюдается не только задержка роста и массы, но и отставание развития позотонических и рефлекторных реакций. При этом наиболее тяжелая диссоциированная задержка формирования тонических и рефлекторных реакций имеется у детей с симметричной формой ЗВУР и с гипотрофией III степени.
- У доношенных новорожденных детей с ЗВУР нарушена циклическая организации сна. У детей с ЗВУР без отставания развития функций ЦНС укорочен цикл сна за счет уменьшения длительности ортодоксальной и парадоксальной фаз. При наличии диссоциированной задержки развития функций ЦНС регистрируется недифференцированный активированный или малоактивированный сон, что указывает на отставание формирования координирующей и интегративной функций ЦНС.
- При внутриутробном развитии в условиях субкомпенсированной хронической плацентарной недостаточности, и, следовательно, хронической гипоксии у доношенных детей при рождении наблюдается низкая антирадикальная активность крови, но при этом увеличена ее общая антиокислительная активность и отсутствует корреляция с интенсивностью ПОЛ, что свидетельствует о дисбалансе систем СРО/АОЗ. Имеется положительная корреляционная связь (r = 0,74, p < 0,05) между изменениями антирадикальной активности и экскрецией с мочой основного метаболита мелатонина —
6-сульфатоксимелатонина (6-СОМТ). - У детей, развивавшихся в условиях хронической плацентарной недостаточности и имеющих ЗВУР, снижена экскреция с мочой основного метаболита мелатонина —
6-сульфатоксимелатонина, что может являться свидетельством низкой продукции в организме ребенка внеэпифизарного мелатонина. - При сочетании у новорожденного ЗВУР с отставанием функционального развития ЦНС наблюдаются наиболее низкие показатели экскреции
6-сульфатоксимелатонина с мочой и тенденция к повышению активности мозгового (СК-ВВ) и сердечного (СК-МВ) изоферментов креатинкиназы. Чем выше показатель активности СК-МВ, тем ниже сократительная способность миокарда и наблюдается замедленная постнатальная перестройка гемодинамики. - У новорожденных детей с ЗВУР и отставанием формирования функций ЦНС в раннем неонатальном периоде жизни наблюдаются неврологические расстройства в виде синдрома гипервозбудимости ЦНС с последующим угнетением ЦНС, что сочетается с нарушением циклической организации сна. К концу раннего неонатального периода, характерного для здоровых доношенных детей, развитие функций ЦНС не происходит.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Женщины репродуктивного возраста, имеющие хроническую патологию некольких функциональных систем организма (нервной, иммунной, эндокринной, сердечно-сосудистой, мочеполовой и т. д.), на этапе планирования семьи и/или при постановке на учет в женской консультации должны быть отнесены в группу высокого риска развития плацентарной недостаточности и синдрома задержки внутриутробного развития плода, что обеспечит своевременное проведение лечебных и профилактических мероприятий.
- Всем доношенным детям, имеющим симметричную или асимметричную форму ЗВУР III степени, необходимо в первые дни жизни провобить неврологический осмотр с использованием шкал оценки постурального, пассивного, активного тонуса и безусловных рефлексов. При выявлении отставания на 4 и более недели от должного развития для данного гестационного возраста или диссоциированного развития следует диагностировать перинатальное поражение ЦНС, требующее лечения и последующее диспансерное наблюдение неврологом в течение первого года жизни.
- Детям, имеющим ЗВУР и отставание формирования позотонических и рефлекторных реакций, необходимо на
7-10 день жизни проводить электроэнцефалографическое исследование сна с целью определения тяжести поражения ЦНС и способности к восстановлению нарушенных функций. Отсутствие формирования циклической организации сна является показанием для назначения корригирующей терапии. - Целесообразно в первые 6 часов жизни проводить исследование состояния ПОЛ, АРА и ОАА всем новорожденным, имеющим тяжелую степень ЗВУР, с целью определения необходимости и способа коррекции имеющихся нарушений.
- При вскармливании новорожденных детей, имеющих симметричную и асимметричную формы ЗВУР III степени, не показан свободный режим (кормление «по требованию» ребенка). Они должны получать непастеризованное материнское молоко, а при его отсутствии — адаптированные молочные смеси нового поколения, обогащенные длинноцепочными полиненасыщенными жирными кислотами и содержащие оптимальное количество триптофана, витаминов и микроэлементов, необходимых для нормализации и поддержания устойчивого равновесия СРО/АОЗ.
- У детей, имеющих симметричную или асимметричную форму ЗВУР III степениЮ необходимо исследовать уровень экскреции
6-СОМТ с мочой при рождении или на 10 день жизни и использовать этот показатель в качестве прогностического признака. - Определение в крови ребенка при рождении активности мозгового и сердечного изоферментов креатинкиназы позволит оценить тяжесть гипоксических повреждений на клеточном уровне. Уровни мозгового изофермента креатинкиназы выше 10 Ед/л и сердечного изофермента выше 110 Ед/л следует считать патологическими и использовать как критерии к назначению терапии, направленной на восстановление нарушенных функций.
СПИСОК ОПУБЛИКОВАННЫХ РАБОТ
- Nitric oxide and hypoxia in pathogenesis of CNS development retardation in newborn infants / I.I. Evsiukova, A.A. Andreeva, A.V. Arutyunian, J.S. Dodkhoev // Advances in Gerontology. — 2001. — Vol. 6. — P.27.
- Евсюкова И.И. Недоношенные дети со ЗВУР (проблемы развития, лечение) / И.И. Евсюкова, Д.С. Додхоев, О.В. Ковальчук-Ковалевская // Материалы научно-практической конференции «Невынашивание беременности и недоношенный ребенок». — Петрозаводск, 2002. — С.
45-46. - Evsiukova I.I. Retardaion of CNS Development in Neonates / I.I. Evsiukova, A.A. Andreeva, J.S. Dodkhoev // Book of Abstracts «Environment and human health». — St.Petersburg, 2003. — P.345.
- Dodkhoev J.S. The activity of Creatine Kinase Brain Isoenzyme in Neonates with Intrauterine Growth Retardation / J.S. Dodkhoev, Zh.N. Toumasova // Book of Abstracts «Environment and human health». — St.Petersburg, 2003. — P.337.
- Байбородов Б.Д. Влияние гипероксической оксигенации на проницаемость эритроцитарных мембран и сорбционная способность эритроцитов у новорожденных, перенесших гипоксию при рождении / Б.Д. Байбородов, Д.С. Додхоев // Анестезиология и реаниматология. — 2003. 1 — № 2. — С.55-57.
- Особенности адаптации новорожденных детей с задержкой внутриутробного развития / И.И. Евсюкова, Б.А. Фоменко, А.А. Андреева, О.В. Ковальчук-Ковалевская, Д.С. Додхоев [и др.] // Журнал акушерства и женских болезней. — 2003. Т.52, № 4. — С.23-27.
- Активность мозгового изофермента креатинкиназы у новорожденных с задержкой внутриутробного развития / Д.С. Додхоев, И.И. Евсюкова, Ж.Н. Тумасова, А.В. Арутюнян // Журнал акушерства и женских болезней. — 2003. — Т.52, № 4. — С.28-32.
- Disorders of the CNS development, diagnosis and retreatment in newborns with intrauterine growth retardation (IUGR) / I.I. Evsiukova, B.A. Fomenko, J.S. Dodokhoev [et al.] // Book of Abstracts «The events of the year in Gynecology and Obsterics». — St.Petersburg, 2004. — P.8.
- Dodkhoev D.S. The brain band of creatine kinase activity in neonates with intrauterine growth retardarion / D.S. Dodkhoev // Book of Abstracts «The events of the year in Gynecology and Obsterics». — St.Petersburg, 2004. — P.25.
- Внутриутробное развитие и ранний неонатальный период у детей с ЗВУР / О.В. Ковальчук-Ковалевская, А.Н. Кянгсеп, М.М. Третьякова, Д.С. Додхоев // III Российский конгресс «Современные технологии в педиатрии и детской хирургии». — Москва, 2004. — С.178.
- Андреева А.А. Состояние сердечно-сосудистой системы и активность сердечного изофермента креатинкиназы у новорожденных с задержкой внутриутробного развития / А.А. Андреева, Ж.Н. Тумасова, Д.С. Додхоев // Росс. вестн. перинатологии и педиатрии. — 2004. — Т.49, № 5. — С.61-62.
- Андреева А.А. Особенности гемодинамики и активность сердечного изофермента креатинкиназы у новорожденных с задержкой внутриутробного развития / А.А. Андреева, Ж.Н. Тумасова, Д.С. Додхоев // Журнал акушерства и женских болезней. — 2004. — Т.53, № 3. — С.18-22.
- Экспрессия мелатонина в плаценте при хронической плацентарной недостаточности / Д.С. Додхоев, Л.Б. Зубжицкая, О.А. Добротворцева [и др.] // Медицинский Академический журнал. — 2005. — Т.5, № 4. — С.89-92.
- Додхоев Д.С. Особенности внутриутробного развития плода при хронической плацентарной недостаточности / Д.С. Додхоев // Известия АН РТ. — 2007. — Т. 159, № 2. — С.60-67.
- Додхоев Д.С. Мелатонин и его роль во внутриутробном развитии плода / Д.С. Додхоев // Здравоохранение Таджикистана. — 2007. — № 3. — С.73-80.
- Интенсивность свободнорадикального окисления и состояние антиоксидантной системы у новорожденных детей, развивавшихся в условиях хронической плацентарной недостаточности / И.И. Евсюкова, А.В. Арутюнян, О.В. Ковалевская, В.М. Прокопенко, Т.И. Опарина, Д.С. Додхоев // Журнал акушерства и женских болезней. — 2007. — Т.56, № 3. — С.50-55.
- Ковальчук-Ковалевская О.В. Влияние эпитиламина на развитие функций ЦНС в раннем неонатальном периоде и на первом году жизни у детей с задержкой внутриутробного развития / О.В. Ковальчук-Ковалевская, Д.С. Додхоев // Журнал акушерства и женских болезней. — 2007. — Т.57, спецвып. — С.24-25.
- Роль мелатонина в раннем онтогенезе человека / И.И. Евсюкова, О.В. Ковальчук-Ковалевская, А.А. Андреева, Д.С. Додхоев [и др.] // Всероссийская научно-практическая конференция «50 лет мелатонину: итоги и перспективы исследований». — Санкт-Петербург, 2008. — С.15.
- Додхоев Д.С. Особенности формирования циклической организации сна у доношенных новорожденных детей с ЗВУР / Д.С. Додхоев // Известия АН РТ. — 2008. — № 3. — С.81-89.
- Додхоев Д.С. Активность свободнорадикального окисления и антиоксидантная защита у новорожденных детей с ЗВУР / Д.С. Додхоев // Паеми Сино (Вестник Авиценны). — 2009. — № 1. — С.118-122.
- Додхоев Д.С. Диагностика нарушений функций ЦНС у новорожденных детей с ЗВУР: методическая разработка / Д.С. Додхоев. — Душанбе, 2009 — 30 с.
СПИСОК СОКРАЩЕНИЙ
СК-ВВ — мозговой изофермент креатинкиназы
СК-МВ — сердечный изофермент креатинкиназы
NO — оксид азота
АОЗ — антиоксидантная защита
АРА — антирадикальная активность
АФК — активные формы кислорода
ДНИЭС — диффузная нейроиммуноэндокринная система
ЗВУР — задержка внутриутробного развития
МТ — мелатонин
НСГ — нейросонография
ОАА — общая антиокислительная активность
ПОЛ — перекисное окисление липидов
СРО — свободнорадикальное окисление
ХЛ — хемилюминесценция
ЦНС — центральная нервная система
ЭхоКГ — эхокардиография
ЭЭГ — электроэнцефалография, электроэнцефалограмма
На правах рукописи
ДОДХОЕВ Джамшед Саидбобоевич
Механизмы задержки внутриутробного развития ребенка при хронической плацентарной недостаточности
14.00.09 — педиатрия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени доктора медицинских наук
Душанбе — 2009
Работа выполнена в учреждении Российской академии медицинских наук «Научно-исследовательский институт акушерства и гинекологии им. Д. О. Отта Северо-Западного отделения РАМН».
Научные консультанты:
доктор медицинских наук, профессор ЕВСЮКОВА Инна Ивановна
доктор биологических наук, профессор АРУТЮНЯН Александр Вартанович
Официальные оппоненты:
доктор медицинских наук, профессор ВОХИДОВ Абдусалом
доктор медицинских наук, профессор СМИРНОВА Наталья Николаевна
доктор медицинских наук, профессор ОЛИМОВА Клавдия Сергеевна
Ведущая организация:
ГОУ ДПО «Санкт-Петербургская медицинская академия последипломного образования Федерального агенства по здравоохранению и социальному развитию» (191015, Санкт-Петербург, ул. Кирочная, д.41)
Защита диссертации состоялась 30 октября 2009 г. в 12 часов на заседании диссертционного совета Д 737.005.02 при Таджикском государственном медицинском университете им. Абуали ибни Сино (734003, Душанбе, проспект Рудаки, д. 139).
Автореферат разослан 30 сентября 2009 года.
Ученый сектетарь диссертационного совета
к.м.н., доцент Л. А. Бабаева